미국 인플레 감축법 약가 여파…첫 인하대상 공개
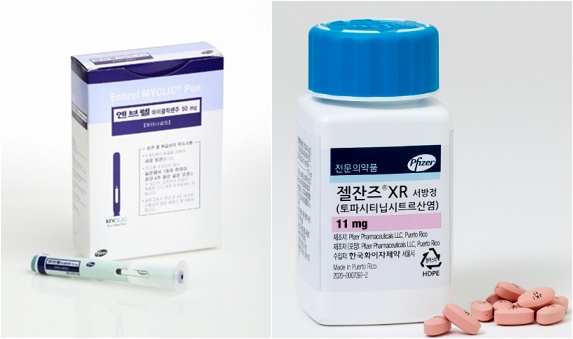
메디칼타임즈=황병우 기자미국에서 시행되는 '인플레이션 감축법(이하 IRA, Inflation Reduction Act)'가 시행되면서 여러 산업군에 여파가 미치는 가운데 미국 내 약가에도 영향을 주고 있다.조 바이든 미국 대통령이 총 7400억 달러(약 966조4400억 원) 규모의 이른바 '인플레이션 감축법(이하 IRA, Inflation Reduction Act)'에 서명하면서 제약바이오업계에도 영향이 예상된다.지난 29일(현지시간) 미국 정부는 인플레이션 감축법에 적용받게 될 1차 약가인하 협상 대상 10개 의약품이 최종 발표했다.IRA는 에너지 안보 및 기후변화 대응에 3690억 달러(약 481조9140억 원), 건강보험개혁법 보조금에 향후 2년간 640억 달러(약 83조5840억 원) 상당을 투자하는 내용을 골자로 한다.IRA의 Subtitle B(Prescription Drug Pricing Reform), Subtitle C(Affordable Care Act subsidies) 부분이 헬스케어와 관련한 내용을 포함하고 있다.Subtitle B는 CMS(Center for Medicare and Medicaid Services)의 약가 협상을 통한 약가 인하가 주 내용이며, Subtitle C는 22년 말까지 예정돼 있었던 ACA(Affordable Care Act, 오바마케어) 보조금을 3년 연장하는 조항을 포함하고 있다.현재 IRA가 제약바이오산업에 가장 큰 영향을 미칠 수 있는 부분은 약가인하로 예측된다.65세 이상의 고령자와 장애인 등 6천 6백만명을 대상으로 하는 메디케어(Medicare) 프로그램에 적용될 가격 협상 대상 의약품은 메디케어 지출액이 가장 많은 의약품 중에서 미국 식품의약국(FDA) 허가 이후 9년 이상 제네릭이 출시되지 않은 화학의약품과 13년 이상 바이오시밀러가 출시되지 않은 바이오의약품을 대상으로 한다.약가 인하 대상은 전문의약품 보험(Medicare Part D) 및 의료 보험(Part B)에 해당되는 의약품이 우선적으로 대상이며, 2026년부터 Part D 10개 의약품에 대한 약가 인하를 시작으로 2027년 Part D 15개, 2028년 Part D 및 Part B 각각 15개, 2029년부터는 Part D 및 Part B 각각 20개 의약품으로 점차 확대할 계획이다.이는 메디케어 프로그램이 시작된 지 60년 만에 처음으로 진행되는 것으로, CMS는 9월 1일 이전에 1차로 10개 약가인하 협상 대상이 되는 10개 의약품을 공개해야 했다.이번에 공개된 10개 의약품의 약가 인하 협상은 2년 정도 소요되며, 2026년부터 인하된 약가가 적용될 예정이다.최종 발표된 10개 약가 인하 협상 대상 의약품은 CMS가 2022년 6월 1일부터 2023년 5월 31일까지 1년간의 메디케어 지출내역을 분석해 선정했으며, 메디케어 Part D 총의료비의 20%에 해당하는 505억 달러가 지출되는 것으로 알려졌다.약가인하 협상 대상에 선정된 치료제를 살펴보면 ▲엘리퀴스 ▲자렐토 ▲자누비아 ▲포시가 ▲엔트레스토 ▲엔브렐 ▲임브루비카 ▲스텔라라 ▲피아스프 등 인슐린 등 10개 치료제가 포함됐다.10개 의약품을 제조하는 기업들은 오는 10월 1일까지 협상에 참여할지를 결정해야 하미국 IRA 약가인하 협상 대상 목록(한국바이오협회 자료 발췌)며, 거부하는 기업들은 메디케어 적용 의약품에서 제외되거나 의약품 매출액의 최대 90%에 해당하는 매출액에 대한 세금이 부과된다.참여하는 기업들은 해당 제품에 관한 연구 개발 투자비, 영업/유통비, 매출액 등의 세부 자료를 올해 안에 제출해야 하고, CMS는 내년 2월 1일까지 기업에 1차 협상 가격을 안내하고 기업들은 30일 이내에 이 협상 가격을 받아들일지 거부할지를 결정해야 한다.이후 CMS는 내년 8월 1일까지 각각의 기업들과 3차례 미팅을 진행해 가격을 확정하게 되며, 한 달 후인 9월 1일까지 최종 인하된 약가가 발표될 예정이다.약가 협상이 마무리되면 2026년 1월 1일부터 제약기업들은 CMS와 협상이 끝난 약가로 인하해 제공해야 하지만 제약기업들이 정부를 상대로 제기한 법률 소송 결과 및 내년에 있을 대통령 선거 결과에 따라 약가 협상과 약가 인하 시점이 변경될 수 있다.다만, 이러한 약가 인하는 공보험에 적용되고 사보험에는 적용되지 않아 사보험 약가 인하에 대한 요구가 커질 수 가능성도 존재하는 상태다.장기적으로 약가인하 협상에 포함된 의약품의 약가 인하 및 매출 하락이 불가피할 것으로 예측되는 모습.IRA에 대해 글로벌 제약사들은 처방 절감에 따른 지출 감소, 신약개발에 대한 악영향을 우려하고 있다.화이자는 "제약 산업에 특정한 조치들에 유감이며 세금을 95%를 부과하는 강한 조치가 포함돼 있어 산업에 큰 영향 예상된다"며 "법안이 그대로 시행된다면 제약 산업의 R&D 투자는 감소할 전망한다"고 말했다.또 암젠은 "IRA로 인한 처방 절감은 다른 비용으로 전환될 수 있으며 노인 환자들 지출 감소를 보장해주지 않는다"며 "정부의 약가 설정은 고령화 인구 치료를 위한 신약 개발에 악영향을 줄 것으로 본다"고 밝혔다.이 때문에 제약업계는 IRA를 두고 미국 정부를 상대로 법률 소송을 제기한 상황이다.현재까지 아스트라제네카, 아스텔라스, BMS, 존슨앤드존슨, MSD, 베링거인겔하임 등 제약사를 비롯해 미국상공회의소, 미국제약협회 등이 개별적으로 소송을 제기한 상태다.한국바이오협회는 "IRA법에 영향받는 제약기업들은 점차 늘어나고 기업들의 매출 감소가 연구 개발 투자비 감소로 이어질 수 있다"며 "향후 외부 기업과의 오픈 이노베이션 생태계에 부정적 영향을 미칠지, 바이오의약품에 대한 투자 증가로 이어질 지 등 변화에 대해 주의 깊게 지켜볼 필요가 있다"고 말했다.